STORM法により広視野での超解像イメージングを実現!
2021年 10月15日
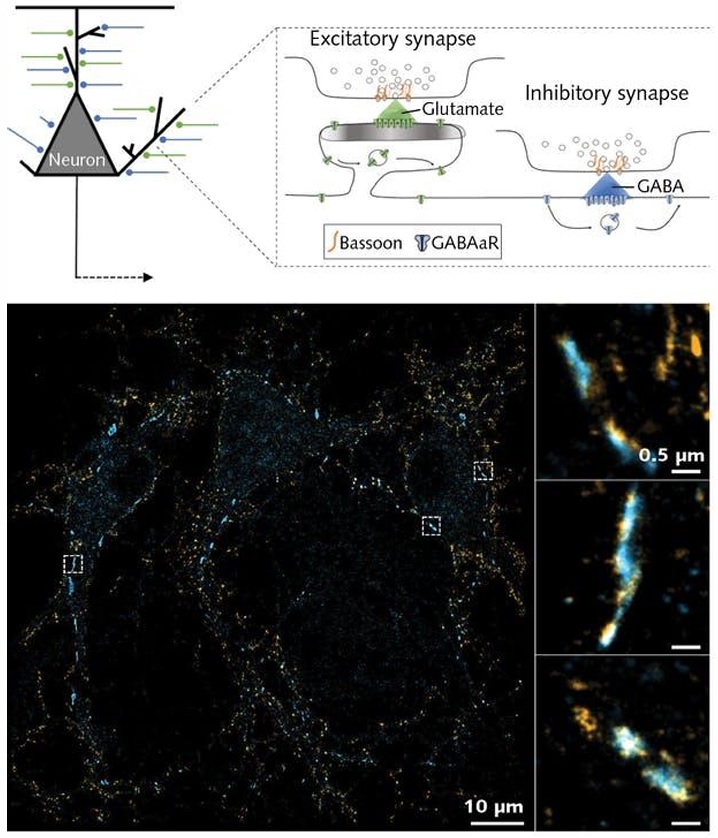
現在、単一分子局在化顕微鏡法(SMLM)は、ナノスケールで生物学的な情報を取得するのに極めて重要な手法となっている。本研究では、わずか1本のレーザーを使って、単一分子局在化顕微鏡法による新たなマルチカラーイメージング手法を確立した。
2021年 10月15日
現在、単一分子局在化顕微鏡法(SMLM)は、ナノスケールで生物学的な情報を取得するのに極めて重要な手法となっている。本研究では、わずか1本のレーザーを使って、単一分子局在化顕微鏡法による新たなマルチカラーイメージング手法を確立した。
