光シート顕微鏡による3次元病理解析
2021年 07月26日
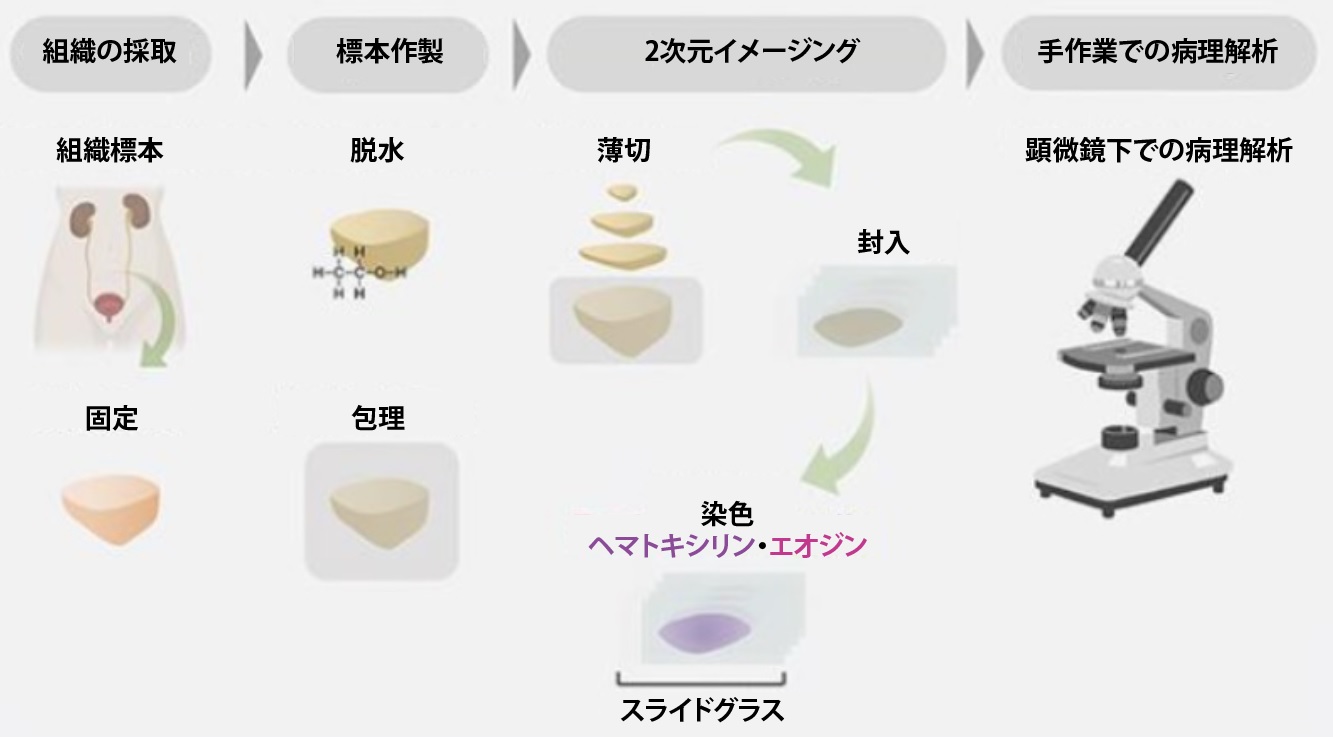
現在、癌の診断に用いられている病理学は、標本の観察は手作業かつ病理医1人での2次元的な評価に依存しているため、1世紀以上にわたって確立されてきた手法であるとはいっても、その診断のプロセスには限界がある。担当病理医によって判定が異なることもあり、生体試料を破壊し、通常解析に必要な量として全体の1% にも満たない検体を患者から採取し検査を行う。
2021年 07月26日
現在、癌の診断に用いられている病理学は、標本の観察は手作業かつ病理医1人での2次元的な評価に依存しているため、1世紀以上にわたって確立されてきた手法であるとはいっても、その診断のプロセスには限界がある。担当病理医によって判定が異なることもあり、生体試料を破壊し、通常解析に必要な量として全体の1% にも満たない検体を患者から採取し検査を行う。
